Physique chimie en 1°S
- Physique chimie en 1 S
- Méthodes
- Séquence 1 : L'image d'un objet
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Repères scientifiques
- Séquence 2 : La couleur d'un objet
- Séquence 3 : Matière et lumière
- Séquence 4 : Des molécules colorées
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Séquence 5 : Concentration d'une solution colorée
- Séquence 6 : Avancement d'une transformation chimique
- Séquence 7 : Interactions fondamentales
- Séquence 8 : Transformations nucléaires
- Objectifs
- Situations d'introduction
- Prérequis
- L'essentiel
- 1) L'atome
- 2) La vallée de la stabilité
- 3) Filiation radioactive
- 4) Désintégration : processus d'émission
- 5) Fission nucléaire
- 6) Fusion nucléaire
- 7) Ajuster une équation : lois de Soddy
- 8) Equivalence masse et énergie
- 9) Décroissance radioactive
- 10) Becquerel, Gray, Sievert : plusieurs unités. Quelles grandeurs ?
- QCM de positionnement
- Séquence 9 : Cohésion et dissolution d'un solide
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- 1) Le solide cristallin, sa formule statistique
- 2) Electronégativité
- 3) Liaison polarisée
- 4) Solide ionique
- 5) Molécules polaires
- 6) Interactions de Van der Walls
- 7) Liaison "hydrogène"
- 8) Des étapes de dissolution
- 9) Equation de dissolution
- 10) Concentration ionique
- 11) Solubilité et miscibilité
- 12) Température d'ébulition
- Activités
- Activité 1 - Tableau périodique et liaisons interatomiques
- Activité 2 - Les liaisons polarisées
- Activité 3 - La molécule d’eau
- Activité 4 - Acétone
- Activité 5 - Tétrachlorométhane
- Activité 6 - Exemple d’une molécule d’acétone en solution dans l’eau
- Activité 7 - Exemples de liaisons hydrogène
- Activité 8 - Cohésion de solide
- Activité 9 - Polaire ou apolaire ?
- Activité 10 - Solubilité - miscibilité
- Activité 11 - Dissolution d’un solide
- Activité 12 - Expérience : dissolution de glucose
- Activité 13 - Réalisation d’une solution
- QCM de positionnement
- Séquence 12 : Formes et transferts d'énergie
Groupes auxochromes
Un groupement d'une molécule peut-il influencer la couleur de la molécule ?
Un auxochrome est un groupement d'atomes ionisables pouvant changer la fréquence d'absorption d'un chromophore. Si la fréquence d'absorption est diminuée, l'effet est dit bathochrome. L'absorption se déplace alors vers les grandes longueurs d'onde, vers l'infrarouge. Lorsque la fréquence d'absorption est augmentée, l'effet est dit hypsochrome. L'absorption se déplace alors vers les petites longueurs d'onde, vers l'ultaviolet.
On distingue :
|
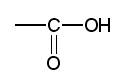
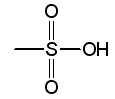
les auxochromes acides : |
|
|
|
|
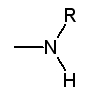
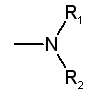
les auxochromes basiques : |
|
|
|
|
les atomes halogènes : |
|
|
|
Loïc Pellan 2016-2017