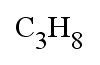Physique chimie en 1°S
4) Représentations d'une molécule
Comment représenter une molécule ?
Plusieurs représentations d'une même molécule sont envisagées selon les informations que l'on souhaite communiquer : la nature et le nombre d'atome (formule brute), mais aussi une idée de la forme du squelette (semi-développée ou topologique), également de la forme globale (développée), la place des doublets non-liants (représentation de Lewis).
- La formule brute est généralement utile pour calculer la masse molaire moléculaire mais ne nous renseigne pas sur la géométrie de la molécule ;
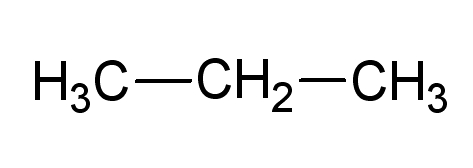
- Dans la formule semi-développée, on ne représente pas les liaisons covalentes liées impliquant un atome d’hydrogène ;
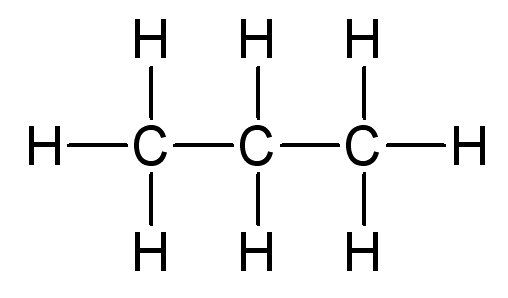
- Dans une représentation développée, tout les doublets liants sont indiqués ;
- Dans une représentation topologique, les atomes du squelette de la molécule et les liaisons de l'atome d'hydrogène avec un autre atome ne sont pas représentés ;
- Lorsque la molécule comporte des doublets non-liants, on choisira une représentation de Lewis.
Représentation du propane
|
Formule brute |
Représentation semi-développée |
Représentation développée |
Représentation topologique |
|
|
|
|
La molécule d’eau de formule brute H2O
|
La formule de Lewis de la molécule d’eau est alors : |
On pourra ainsi représenter la formule de Lewis d’une molécule à partir de la formule développée à laquelle on associe les doublets non-liants.
| Méthode pour écrire la formule de Lewis d’une molécule | |
| a) | Écrire le nom et la formule brute de la molécule (la formule brute indique seulement la nature et le nombre des atomes qui constituent la molécule). |
| b) | À partir numéros atomiques, écrire la structure électronique de tous les atomes de la molécule. En déduire le nombre d’électrons de la couche externe pour chaque atome. |
| c) | Établir le nombre de liaisons (valence) que doit former chaque atome en utilisant la règle du «duet» ou de l’octet. |
| d) | Écrire la formule développée de la molécule en plaçant des doublets liants (liaison) entre les atomes. |
| e) | Déterminer le nombre de doublets non liants pour chaque atome en comptant le nombre d’électrons de la couche externe non engagés dans des liaisons avec d’autres atomes. |
| f) | Répartir ces doublets non liants autour des atomes concernés. |
| g) | Vérifier de nouveau les règles du duet et de l’octet. |