Physique chimie en 1°S
- Physique chimie en 1 S
- Méthodes
- Séquence 1 : L'image d'un objet
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Repères scientifiques
- Séquence 2 : La couleur d'un objet
- Séquence 3 : Matière et lumière
- Séquence 4 : Des molécules colorées
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Séquence 5 : Concentration d'une solution colorée
- Séquence 6 : Avancement d'une transformation chimique
- Séquence 7 : Interactions fondamentales
- Séquence 8 : Transformations nucléaires
- Objectifs
- Situations d'introduction
- Prérequis
- L'essentiel
- 1) L'atome
- 2) La vallée de la stabilité
- 3) Filiation radioactive
- 4) Désintégration : processus d'émission
- 5) Fission nucléaire
- 6) Fusion nucléaire
- 7) Ajuster une équation : lois de Soddy
- 8) Equivalence masse et énergie
- 9) Décroissance radioactive
- 10) Becquerel, Gray, Sievert : plusieurs unités. Quelles grandeurs ?
- QCM de positionnement
- Séquence 9 : Cohésion et dissolution d'un solide
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- 1) Le solide cristallin, sa formule statistique
- 2) Electronégativité
- 3) Liaison polarisée
- 4) Solide ionique
- 5) Molécules polaires
- 6) Interactions de Van der Walls
- 7) Liaison "hydrogène"
- 8) Des étapes de dissolution
- 9) Equation de dissolution
- 10) Concentration ionique
- 11) Solubilité et miscibilité
- 12) Température d'ébulition
- Activités
- Activité 1 - Tableau périodique et liaisons interatomiques
- Activité 2 - Les liaisons polarisées
- Activité 3 - La molécule d’eau
- Activité 4 - Acétone
- Activité 5 - Tétrachlorométhane
- Activité 6 - Exemple d’une molécule d’acétone en solution dans l’eau
- Activité 7 - Exemples de liaisons hydrogène
- Activité 8 - Cohésion de solide
- Activité 9 - Polaire ou apolaire ?
- Activité 10 - Solubilité - miscibilité
- Activité 11 - Dissolution d’un solide
- Activité 12 - Expérience : dissolution de glucose
- Activité 13 - Réalisation d’une solution
- QCM de positionnement
- Séquence 12 : Formes et transferts d'énergie
Activité 13 - Réalisation d’une solution
On désire réaliser une solution de sulfate d’aluminium, de concentration 0,200 mol.L-1 en ions aluminium. La fiole jaugée qui va être utilisée est une fiole de 100,0 mL. Le solide utilisé est du sulfate d’aluminium anhydre de formule Al2(SO4)3. La masse molaire de ce composé est de M = 342,2 g.mol-1. On considère que le sulfate d’aluminium est complètement dissout en solution à la fin de la préparation.
Réflexivité
1) Compléter le tableau d'avancement ci-dessous :
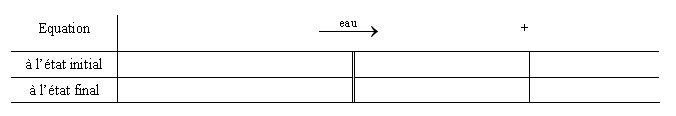
Réflexivité
2) Déterminer l’expression littérale de la masse à prélever.
Réflexivité
3) Déterminer la masse à prélever, en étant attentif au nombre de chiffres significatifs.
Loïc Pellan 2016-2017