- Physique chimie en 1 S
- Méthodes
- Séquence 1 : L'image d'un objet
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Repères scientifiques
- Séquence 2 : La couleur d'un objet
- Séquence 3 : Matière et lumière
- Séquence 4 : Des molécules colorées
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Séquence 5 : Concentration d'une solution colorée
- Séquence 6 : Avancement d'une transformation chimique
- Séquence 7 : Interactions fondamentales
- Séquence 8 : Transformations nucléaires
- Objectifs
- Situations d'introduction
- Prérequis
- L'essentiel
- 1) L'atome
- 2) La vallée de la stabilité
- 3) Filiation radioactive
- 4) Désintégration : processus d'émission
- 5) Fission nucléaire
- 6) Fusion nucléaire
- 7) Ajuster une équation : lois de Soddy
- 8) Equivalence masse et énergie
- 9) Décroissance radioactive
- 10) Becquerel, Gray, Sievert : plusieurs unités. Quelles grandeurs ?
- QCM de positionnement
- Séquence 9 : Cohésion et dissolution d'un solide
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- 1) Le solide cristallin, sa formule statistique
- 2) Electronégativité
- 3) Liaison polarisée
- 4) Solide ionique
- 5) Molécules polaires
- 6) Interactions de Van der Walls
- 7) Liaison "hydrogène"
- 8) Des étapes de dissolution
- 9) Equation de dissolution
- 10) Concentration ionique
- 11) Solubilité et miscibilité
- 12) Température d'ébulition
- Activités
- Activité 1 - Tableau périodique et liaisons interatomiques
- Activité 2 - Les liaisons polarisées
- Activité 3 - La molécule d’eau
- Activité 4 - Acétone
- Activité 5 - Tétrachlorométhane
- Activité 6 - Exemple d’une molécule d’acétone en solution dans l’eau
- Activité 7 - Exemples de liaisons hydrogène
- Activité 8 - Cohésion de solide
- Activité 9 - Polaire ou apolaire ?
- Activité 10 - Solubilité - miscibilité
- Activité 11 - Dissolution d’un solide
- Activité 12 - Expérience : dissolution de glucose
- Activité 13 - Réalisation d’une solution
- QCM de positionnement
- Séquence 12 : Formes et transferts d'énergie
A l'intérieur de l'atome
L’atome est le constituant de base de la matière. Dans le noyau de l’atome se trouvent les protons (chargés positivement) et les neutrons (non chargés), tandis que les électrons (chargés négativement) sont localisés autour du noyau.
Son nombre de protons ou numéro atomique est noté Z. L’atome étant neutre, il comporte autant d’électrons que de protons. Ainsi le numéro atomique détermine les propriétés chimiques de l’atome.
A chaque valeur de Z correspond un nom d’atome, un élément chimique. Ainsi l’hydrogène possède 1 proton, tandis que le carbone en possède 6.
Le nombre de neutrons au sein du noyau est désigné par la lettre N. Le nombre de masse A est la somme de Z+N. Pour un atome de Z donné, on peut compter plusieurs isotopes, en fonction du nombre de neutrons.
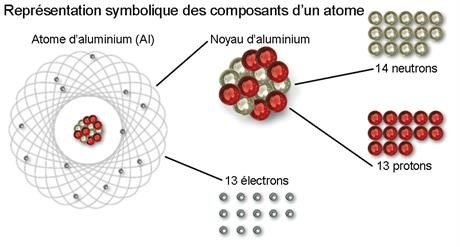
L’aluminium possède 13 protons (Z=13) et son seul isotope stable possède 14 neutrons (A = 14+13 = 27) © CEA