- Physique chimie en 1 S
- Méthodes
- Séquence 1 : L'image d'un objet
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Repères scientifiques
- Séquence 2 : La couleur d'un objet
- Séquence 3 : Matière et lumière
- Séquence 4 : Des molécules colorées
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Séquence 5 : Concentration d'une solution colorée
- Séquence 6 : Avancement d'une transformation chimique
- Séquence 7 : Interactions fondamentales
- Séquence 8 : Transformations nucléaires
- Objectifs
- Situations d'introduction
- Prérequis
- L'essentiel
- 1) L'atome
- 2) La vallée de la stabilité
- 3) Filiation radioactive
- 4) Désintégration : processus d'émission
- 5) Fission nucléaire
- 6) Fusion nucléaire
- 7) Ajuster une équation : lois de Soddy
- 8) Equivalence masse et énergie
- 9) Décroissance radioactive
- 10) Becquerel, Gray, Sievert : plusieurs unités. Quelles grandeurs ?
- QCM de positionnement
- Séquence 9 : Cohésion et dissolution d'un solide
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- 1) Le solide cristallin, sa formule statistique
- 2) Electronégativité
- 3) Liaison polarisée
- 4) Solide ionique
- 5) Molécules polaires
- 6) Interactions de Van der Walls
- 7) Liaison "hydrogène"
- 8) Des étapes de dissolution
- 9) Equation de dissolution
- 10) Concentration ionique
- 11) Solubilité et miscibilité
- 12) Température d'ébulition
- Activités
- Activité 1 - Tableau périodique et liaisons interatomiques
- Activité 2 - Les liaisons polarisées
- Activité 3 - La molécule d’eau
- Activité 4 - Acétone
- Activité 5 - Tétrachlorométhane
- Activité 6 - Exemple d’une molécule d’acétone en solution dans l’eau
- Activité 7 - Exemples de liaisons hydrogène
- Activité 8 - Cohésion de solide
- Activité 9 - Polaire ou apolaire ?
- Activité 10 - Solubilité - miscibilité
- Activité 11 - Dissolution d’un solide
- Activité 12 - Expérience : dissolution de glucose
- Activité 13 - Réalisation d’une solution
- QCM de positionnement
- Séquence 12 : Formes et transferts d'énergie
d) Le numéro atomique
Après rotation d’une partie de la molécule autour de l’axe de la liaison double, on constate que les formes ne sont pas superposables. Il est donc nécessaire de les différencier : l’isomère E ou l’isomère Z ?
Pour identifier l’isomère Z ou E, on repère chaque premier voisin du carbone de la liaison double. Ici, les atomes de carbone (entouré en orange).
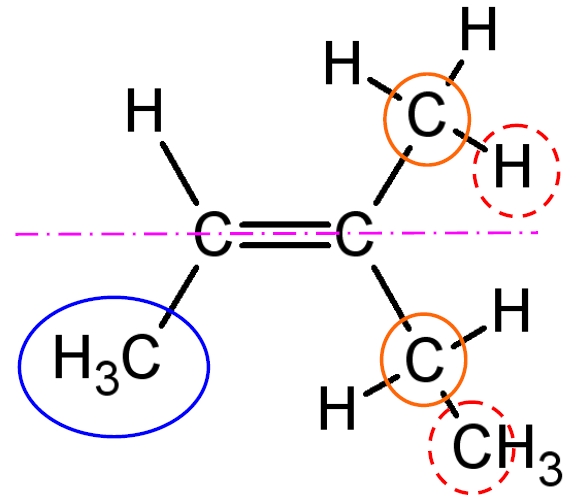 |
Chacun de ces deux atomes de carbone a le même numéro atomique (Z = 6) : on ne peut pas les différencier ! On se reporte alors aux voisins du deuxième rang. Ainsi, on compare le numéro atomique de l’atome d’hydrogène (Z = 1) (entouré en pointillé) avec celui du carbone (Z = 6) (entouré en pointillé). On considère donc le groupe éthyl (-CH2-CH3).
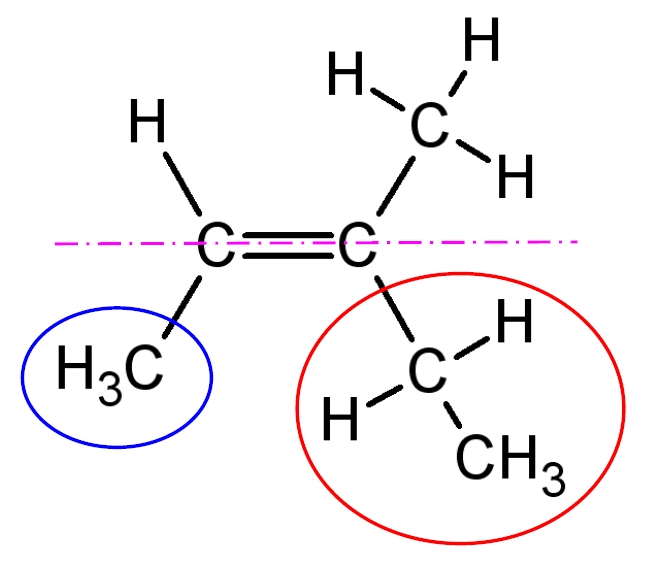 |
Le groupe méthyl (-CH3) et le groupe éthyl (-CH2-CH3) sont du même coté de l’axe de la liaison double : c’est la représentation de l’isomère Z.
 |