- Physique chimie en 1 S
- Méthodes
- Séquence 1 : L'image d'un objet
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Repères scientifiques
- Séquence 2 : La couleur d'un objet
- Séquence 3 : Matière et lumière
- Séquence 4 : Des molécules colorées
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- QCM de positionnement
- Séquence 5 : Concentration d'une solution colorée
- Séquence 6 : Avancement d'une transformation chimique
- Séquence 7 : Interactions fondamentales
- Séquence 8 : Transformations nucléaires
- Objectifs
- Situations d'introduction
- Prérequis
- L'essentiel
- 1) L'atome
- 2) La vallée de la stabilité
- 3) Filiation radioactive
- 4) Désintégration : processus d'émission
- 5) Fission nucléaire
- 6) Fusion nucléaire
- 7) Ajuster une équation : lois de Soddy
- 8) Equivalence masse et énergie
- 9) Décroissance radioactive
- 10) Becquerel, Gray, Sievert : plusieurs unités. Quelles grandeurs ?
- QCM de positionnement
- Séquence 9 : Cohésion et dissolution d'un solide
- Objectifs
- Situation d'introduction
- Prérequis
- L'essentiel
- 1) Le solide cristallin, sa formule statistique
- 2) Electronégativité
- 3) Liaison polarisée
- 4) Solide ionique
- 5) Molécules polaires
- 6) Interactions de Van der Walls
- 7) Liaison "hydrogène"
- 8) Des étapes de dissolution
- 9) Equation de dissolution
- 10) Concentration ionique
- 11) Solubilité et miscibilité
- 12) Température d'ébulition
- Activités
- Activité 1 - Tableau périodique et liaisons interatomiques
- Activité 2 - Les liaisons polarisées
- Activité 3 - La molécule d’eau
- Activité 4 - Acétone
- Activité 5 - Tétrachlorométhane
- Activité 6 - Exemple d’une molécule d’acétone en solution dans l’eau
- Activité 7 - Exemples de liaisons hydrogène
- Activité 8 - Cohésion de solide
- Activité 9 - Polaire ou apolaire ?
- Activité 10 - Solubilité - miscibilité
- Activité 11 - Dissolution d’un solide
- Activité 12 - Expérience : dissolution de glucose
- Activité 13 - Réalisation d’une solution
- QCM de positionnement
- Séquence 12 : Formes et transferts d'énergie
4) Solide ionique
Les alcalins (éléments de la première colonne), les alcalino-terreux (éléments de la deuxième colonne) ont tendance à perdre un ou deux électrons, alors que les halogènes (fluor, chlore,brome, iode) ont tendance à gagner un électron : ils forme des ions. Prenons l'exemple du chlorure de sodium (NaCl) : le solide est constitué d'ions sodium (ICI) et d'ions chlorure (ICI). Le chlorure de sodium est donc un solide ionique.
Lorsque la différence d'électronégativité est supérieure à 1,6, on considère que la liaison est ionique. La cohésion est alors expliquée par l'interaction attractive entre deux charges de signe opposé.
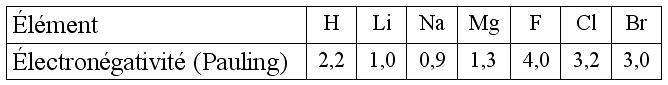
Calculons la différence d'électronégativité du chlorure de sodium :
La liaison est ionique car la valeur de la différence d'électronégativité est supérieure à 1,6.