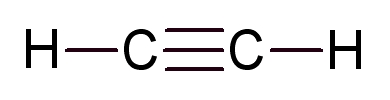3) Doublet liant ou doublet non-liant ?
Comment se répartissent les électrons dans une molécule ?
Une molécule est un assemblage d’atomes associés les uns aux autres par des liaisons chimiques mettant en jeu des électrons de valence des différents atomes. On distingue plusieurs situations :
a) La liaison covalente
Une liaison de covalence résulte de la mise en commun de deux électrons de valence, chaque atome apportant un électron : on parle d'un doublet liant.
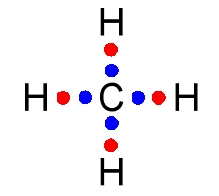
La molécule de méthane est formée des éléments chimiques carbone et hydrogène. L’atome d’hydrogène est constitué d’un seul électron, l’atome de carbone de 6 électrons dont 4 dans la couche externe. Les structures électroniques sont respectivement et .
|
|
|
|
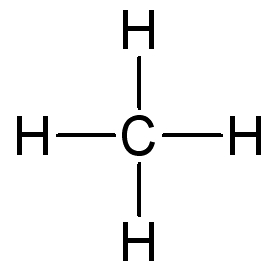
Une paire d’électrons liants est représentée par un tiret |
|
En s'associant avec quatre atomes d''hydrogène, l'atome de carbone partage ses 4 électrons de valence avec ses quatre voisins. En s’associant à un atome de carbone, chaque atome d’hydrogène partage son électron.
L’environnement électronique de l’atome de carbone peut être décrit par 4 électrons externes (en bleu) issus de sa propre structure et de 4 électrons (en rouge) issus de ses voisins. La règle de l’octet est ainsi vérifiée.
Quant à l’atome d’hydrogène, 2 électrons constituent son environnement électronique : 1 électron issu de sa structure électronique (en rouge) et un deuxième issu du carbone voisin. La règle du duet est également vérifiée.
Remarque : les électrons d’un doublet liant sont indiscernables : ils ne sont associés spécifiquement ni à l’atome de carbone, ni à celui d’hydrogène. La stabilité de la liaison est justifiée du fait que l’énergie des électrons associés par paire est plus basse que celle des électrons considérés séparément.
La valence d'un atome correspond au nombre d'autres atomes auquel il peut se lier. L’atome d’hydrogène est monovalent, celui de carbone est tétravalent.
b) Liaisons multiples
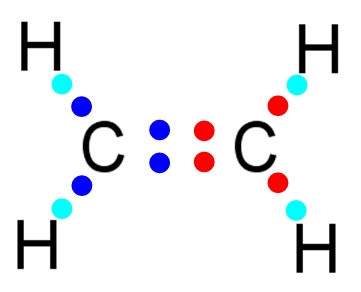
Deux atomes voisins peuvent former dans certains cas une liaison double ou une liaison triple.
Dans cette situation un atome partage avec un même voisin deux ou trois électrons.
Citons quelques exemples.
|
Éthylène |
 |
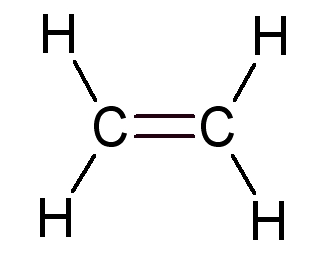 |
|
Acéthylène |
|
|
|
Cyanure d'hydrogène |
c) Les doublets non liants
Certains atomes possèdent des électrons qui ne participent pas à la formation des liaisons covalentes et qui sont répartis en doublets. Ces doublets d’électrons sont appelés doublets non liants.
La molécule d’eau de formule brute H2O
La molécule d’eau est formée des éléments chimiques oxygène et hydrogène. L’atome d’oxygène est constitué de 8 électrons dont 6 dans la couche externe et l’atome d’hydrogène d’un électron. Les structures électroniques sont respectivement et pour les éléments chimiques hydrogène et oxygène.
Chaque atome d’hydrogène a partagé son électron de la couche externe (rouge) pour réaliser un doublet liant avec l’atome d’oxygène et l'atome d'oxygène a partagé deux électrons de valence (bleu) avec ses voisins : il s'est formé deux doublets liants.
|
|
|
Une paire d’électrons liants est représentée par un tiret. |
L’atome d’oxygène a engagé 2 de ses 6 électrons (bleu) de la couche externe pour réaliser les liaisons avec les atomes d’hydrogène ; il lui reste donc 4 électrons qui vont former deux doublets non-liants.
|
|
|
Une paire d’électrons non-liants est représentée par un tiret. |
On peut vérifier :
- la règle du duet : chaque atome d’hydrogène est entouré de 2 électrons ;
- la règle de l’octet : l’atome d’oxygène est entouré de 8 électrons issus de 2 doublets liants et de deux doublets non-liants.