7) Géométrie d'une molécule
La représentation développée reflète-t-elle la géométrie d'une molécule ?
Il est possible de répondre en considérant que les doublets constitués d’électrons chargés négativement ont tendance à s’éloigner le plus possible les uns des autres. Dans quelle position dans l’espace, ces doublets vont-ils se disposer sachant qu’ils ont tendance à se repousser ?
Pour pouvoir étudier la géométrie de la molécule de méthane, il faut donc représenter simplement sur une feuille de papier (soit en deux dimensions) la structure spatiale d’une molécule tridimensionnelle : on adopte alors la représentation de Cram :
|
||
|
||
|
||
a) La molécule d'eau
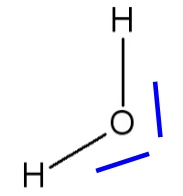
La molécule d’eau peut être représentée par la formule de Lewis qui met en évidence les doublets liants opposés (angle entre les deux liaisons de 180°) et les doublets non-liants.
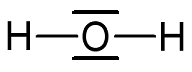 |
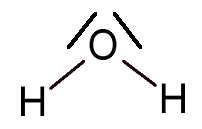
Cependant des mesures expérimentales montrent la géométrie de la molécule d’eau est coudée : l’angle entre les 2 liaisons O-H est d’environ 104,5°.
 |
Comment expliquer ce fait expérimental ?
La molécule d’eau a une structure coudée parce les doublets liants ou non liants qui entourent l’atome d’oxygène (atome central) se repoussent pour adopter une position d’éloignement maximal, c’est-à-dire de plus grande stabilité (de moindre répulsion).
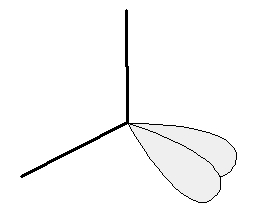
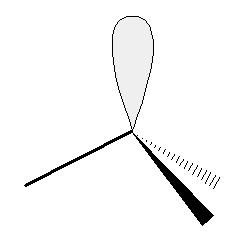
Il n’y a pas que les doublets liants qui se repoussent. Les deux doublets non liants sont aussi à prendre en compte. Comme il y a 4 doublets d’électrons autour de l’atome d’oxygène, ils vont se disposer selon un tétraèdre et l’angle entre les deux liaisons O-H est donc proche de 109°.
|
|
|
|
Représentation des doublets non-liants |
|
Remarque : les doublets non liants prennent même un peu plus de place que les doublets liants autour de l’atome central puisque l’angle entre les 2 liaisons O – H est légèrement inférieur à celui entre les liaisons C – H du méthane.
b) La molécule de méthane
| Représentation de Cram du méthane : | 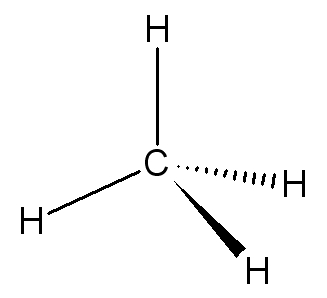 |
| La molécule a une structure tétraédrique dans laquelle l’angle entre 2 liaisons C-H est 109°. | |
c) La molécule d'ammoniac
| Représentation de Cram de l'ammoniac : | 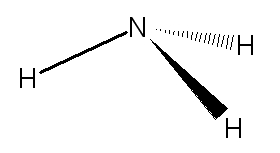 |
 |
| La molécule a une structure pyramidale trigonale dans laquelle l’angle entre 2 liaisons N-H est 107°. | ||