3) Liaison polarisée
Le chlorure d’hydrogène est constitué de molécules HCl dans lesquelles l’atome d’hydrogène est lié à l’atome de chlore par une liaison covalente. Elle est représentée par la formule de Lewis suivante.
|
|
Le chlore est beaucoup plus électronégatif que l’hydrogène. Il attire donc vers lui le doublet de liaison.
Lorsque la différence d'électronégativité est inférieure à 0,5, on considère que la liaison n'est pas polarisée. C'est le cas des liaisons C-C ou C-H.
Lorsque la différence d'électronégativité est comprise entre 0,5 et 1,6, on considère que la liaison est polarisée.
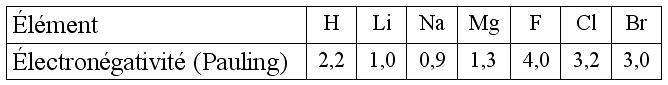
Calculons la différence d'électronégativité du chlorure de sodium :
La liaison est polarisée car la valeur de la différence d'électronégativité est comprise entre 0,5 et 1,6.
Cette polarisation fait apparaître :
- un excédant de charge partielle négative, noté – q ou , sur l’atome le plus électronégatif (le chlore).
- un excédant de charge partielle positive, noté + q ou , sur l’atome le plus électronégatif (l'hydrogène).
La molécule de chlorure d’hydrogène a un caractère dipolaire : elle constitue un dipôle électrique.
Elle peut être représentée par un dipôle portant les charges – q ( ) et + q ( ).
Une liaison covalente est donc polarisée lorsque les deux atomes liés ont des électronégativités différentes. Plus la différence d’électronégativité est importante, plus la liaison est polarisée.
La cohésion est alors expliquée par l'interaction attractive entre deux charges partielles de signe opposé.